Révéler les « secrets » de l'action des médicaments pour une médecine ciblée
Qu’arriverait-il si on pouvait seulement conserver les effets bénéfiques d’un médicament sans avoir les effets non-désirés? C’est justement l’idée derrière les travaux que mène le professeur Stéphane Laporte dans son laboratoire au site Glen de l’Institut de recherche du Centre universitaire de santé McGill (IR-CUSM).
Depuis plusieurs années, il travaille à prédire le profil pharmacologique des médicaments, en vue d’offrir une médecine plus personnalisée à la population. Son équipe a développé, avec celle du professeur Michel Bouvier de l’Institut de recherche en immunologie et en cancérologie de l’Université de Montréal (UdeM), des biocapteurs luminescents pouvant être utilisés pour « illuminer » les différentes voies de signalisation d’un médicament dans les cellules, c’est-à-dire leur mode d’action dans l’organisme. L’objectif des chercheurs est de faciliter l’identification de nouvelles molécules thérapeutiques plus efficaces et plus sécuritaires.
« Avec cette nouvelle technologie de biocapteurs, nous sommes capables pour chaque médicament testé de connaître les voies de signalisation qui sont activées, et donc de conserver uniquement les molécules qui conduisent aux effets désirés sans présenter d’effets secondaires ou d’induire de tolérance au traitement », dit Stéphane Laporte, scientifique au sein du Programme de recherche en désordres métaboliques et leurs complications de l’IR-CUSM et professeur dans la Division d'endocrinologie et de métabolisme à l’Université McGill.

« Prenez l’exemple du fentanyl ou de la morphine, qui sont de puissants analgésiques utilisés pour soulager la douleur. En connaissant tous leurs sentiers de signalisation, on pourrait développer de nouveaux opioïdes qui conservent leur effet antidouleur et éliminer leurs effets adverses comme la dépression respiratoire ou la constipation. »
Le potentiel pharmacologique et les retombées économiques de cette technologie novatrice sont tellement prometteurs que les chercheurs québécois ont signé un accord de licence en 2013 avec la société biopharmaceutique française Domain Therapeutics et deux importants partenariats avec les géants pharmaceutiques américains Bristol-Myers Squibb et Pfizer qui utilisent actuellement la technologie de biocapteurs. Le professeur Laporte s’attend à ce que de nouveaux médicaments plus ciblés et efficaces soient mis à la disposition de la population d’ici les cinq à dix prochaines années.
« Je suis très heureux de ces accomplissements rendus possible grâce au travail de mon équipe et de nos multiples collaborations durant toutes ces années », dit le professeur Laporte. L’intérêt des industries pharmaceutiques est révélateur du leadership et de l’expertise de nos laboratoires et collaborateurs à McGill, à l’UdeM ainsi qu’à l’Université de Sherbrooke dans le domaine des biocapteurs. Cette synergie entre ces centres de recherche majeurs ici, au Québec, me rend d’autant plus fier. »
Les professeurs Laporte et Bouvier travaillent de pair avec des collaborateurs clés tels que Terry Hébert de l’Université McGill, Richard Leduc de l’Université de Sherbrooke, et Graciela Pineyro de l’UdeM.

Une technologie ciblant les récepteurs couplés aux protéines G
Environ 40 % des médicaments prescrits – que ce soit des médicaments pour le cœur comme les bétabloquants, ou des opioïdes pour la douleur chronique – ciblent une classe de protéines chez l’humain qu’on appelle les récepteurs couplés aux protéines G (RCPG). Ces récepteurs activent des protéines qui à leur tour peuvent activer différents sentiers de signalisation d’un médicament.
« Les RCPG sont des protéines logées dans la membrane des cellules et contribuent à de nombreuses réponses physiologiques, telles que les contractions du cœur ou de l'utérus, le contrôle de la tension artérielle, la libération du glucose et même notre capacité de voir, de goûter ou de sentir », explique le professeur Laporte.
Même si actuellement, plus de 800 RCPG sont connus et contrôlent divers types de processus dans le corps humain, les RCPG renferment encore beaucoup de mystères pour les scientifiques. Les professeurs Laporte et Bouvier, eux, en connaissent un bout sur le sujet. Ils ont tous les deux fait leur études postdoctorales à l'université Duke, aux États-Unis, dans les laboratoires du professeur Marc Caron et du Dr Robert Lefkowitz, ce dernier considéré comme l’un des « pères » des RCPG et le lauréat du prix Nobel de chimie 2012.
Depuis son retour au Québec, le professeur Laporte et son équipe se concentrent sur la compréhension des mécanismes moléculaires et cellulaires qui régulent les RCPG dans les cellules vivantes. C’est en collaborant avec le professeur Bouvier qu’ils sont arrivés à mettre au point une première technologie de biocapteurs de RCPG en 2013 et n’ont cessé de la perfectionner depuis.
« Ce qui est extraordinaire, c’est que notre technologie évalue de façon très rapide et très efficace tous les sentiers de signalisation qui sont activés par différents médicaments, lance le professeur Laporte. De plus, ces biocapteurs peuvent être utilisés pour prédire le profil pharmacologique d’innombrables molécules dans divers domaines comme la cardiologie, l’endocrinologie, la neurologie et la cancérologie. »
La nature au service de la science
Pour créer cette technologie de biocapteurs luminescents, les scientifiques se sont inspirés d’un mécanisme naturel qu’on retrouve chez beaucoup d’organismes vivants, et en particulier chez les organismes marins : la bioluminescence. Certaines méduses, algues, ou plancton produisent une lumière obtenue par une réaction chimique entre la luciférine (substrat luminescent) et une enzyme, la luciférase, au cours de laquelle l'énergie chimique est convertie en énergie lumineuse.
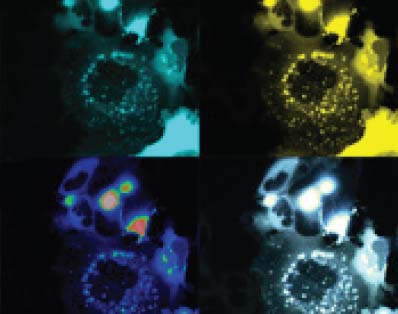
Cette énergie lumineuse est ensuite utilisée pour exciter une autre protéine fluorescente, aussi présente chez ces organismes. Dans ce cas-ci, les chercheurs se sont servis de la pensée de mer, un organisme marin appartenant au même embranchement qui comprend aussi les méduses et les coraux.
L’équipe de chercheurs a donc pris la luciférase et la protéine fluorescente de la pensée de mer et les ont assemblées sur les protéines et le récepteur à l’étude. Et comme pour les organismes marins, le récepteur d’intérêt rentre en contact avec une autre molécule, déclenche une réponse cellulaire, et va émettre de la lumière et de la fluorescence qui seront détectées, indiquant ainsi quelle voie de signalisation dans la cellule est activée.
« En moins de quelques minutes, nous sommes capables de passer au crible près d’une centaine de récepteurs ou molécules chimiques d’intérêt qui sont de potentielles cibles thérapeutiques ou médicaments pour les problèmes liés au système nerveux central, pour les maladies métaboliques, cardiovasculaires, respiratoires, urinaires ou gastro-intestinales », explique le professeur Laporte.
Grâce à leur expertise sur les RCPG reconnue au niveau mondial et à cette nouvelle technologie plus puissante, les deux chercheurs, ainsi que leurs collaborateurs ont ouvert la porte à une multitude de possibilités concernant le développement de médicaments plus efficaces et personnalisés.
« Dorénavant, les compagnies pharmaceutiques pourront plus facilement cribler leur librairie pharmacologique et vérifier si de nouvelles molécules peuvent activer les RCPG qui restent encore non exploités, dans le but de développer des traitements plus adaptés à la physiologie des patients et présentant moins de risques d’effets secondaires », conclut-il.
Lisez le Tête-à-tête avec Stéphane Laporte à rimuhc.ca/face-to-face
Fait saillant
Les travaux de l’équipe du professeur Laporte, en collaboration des chercheurs de l'UdeM, ont également permis de développer et valider une molécule qui se lie à un RCPG et qui à travers la voie de signalisation activée, bloque les contractions utérines dans des modèles précliniques. Ce médicament est en train d’être testé auprès des femmes souffrant de dysménorrhée, un syndrome peu connu qui engendre des contractions utérines douloureuses pendant les menstruations. Ce traitement pourrait éventuellement mener au développement de nouvelles classes de médicaments pour prévenir les accouchements prématurés chez les femmes enceintes.